参考文献
[1] TIDMAN R, THUMBI S M, WALLACE R, et al. United Against Rabies Forum: The One Health Concept at Work[J]. Frontiers in Public Health, 2022, 10: 854419. DOI:10.3389/fpubh.2022.854419.
[2] World Health Organization. Rabies[EB/OL]. (2021-01-21)[2025-09-25].
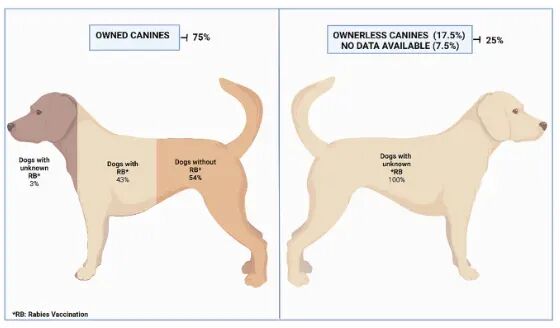
[3] 央视网. 犬只免疫率不足30%!狂犬病防治之问:谁更该打疫苗?[EB/OL]. (2023-05-10)[2025-09-25].
[4] UTAMI N W A, AGUSTINA K K, ATEMA K N,et al. Evaluation of Community-Based Dog Welfare and Rabies Project in Sanur, a Sub-district of the Indonesian Island Province of Bali[J]. Frontiers in Veterinary Science, 2019, 6: 193. DOI:10.3389/fvets.2019.00193.
[5]Liu X, Li J, Zha Y,et al. The efficacy and safety of SYN023 (Zamerovimab and Mazorelvimab injection), the recombinant humanized anti-rabies virus monoclonal antibody mixture, combined with rabies vaccine in a WHO category III rabies post-exposure population: A randomized, double-blind, positive control, phase III clinical trial[J]. Vaccine. 2025 Aug 13;61:127289. DOI: 10.1016/j.vaccine.2025.127289.
[6] Aditham A K , Radford C E , Carr C R ,et al.Deep mutational scanning of rabies glycoprotein defines mutational constraint and antibody-escape mutations[J]. 2024.DOI:10.1101/2024.12.17.628970.
[7] Armbruster N, Jasny E, Petsch B.Advances in RNA Vaccines for Preventive Indications: A Case Study of a Vaccine against Rabies[J].Vaccines, 2019, 7(4).DOI:10.3390/vaccines7040132.
[8] DAVIS P, MONTROY J, WARSHAWSKY B,et al. Immunogenicity of pre-exposure rabies vaccination comparing number of doses and routes of administration: A systematic review and meta-analyses[J]. Vaccine, 2025, 53: 126878. DOI:10.1016/j.vaccine.2025.126878.



 CHTV 百姓健康微信
CHTV 百姓健康微信